# 导 读 #
采用加标比对试验探索培养温度和时间对酶底物法检测饮用水中嗜肺军团菌的影响;在确定最适培养条件后,采集饮用水水样进行检测并通过16S rDNA序列GenBank比对试验对阳性结果进行确证。结果表明,酶底物法检测饮用水中嗜肺军团菌的最适培养条件为39 ℃恒温培养7 d,嗜肺军团菌检出浓度与理论浓度基本一致,加标回收率范围为98.4%~108.8%;对北方城市部分饮用水水样进行嗜肺军团菌检测,检测发现阳性水样4份,经乳胶凝集血清分型试验和16S rDNA序列分析确证均为嗜肺军团菌。

0 引言
军团菌(Legionella)是一种常见的水源性致病微生物,广泛存在于各种水环境中,特别是在包括饮用水在内的人工水体中。目前空调冷却水、喷泉水等非饮用水中军团菌污染问题已引起各国研究者的广泛关注,而饮用水中军团菌污染的相关研究较少。但近年来饮用水系统被军团菌污染事件时有发生,特别是2020年受新冠疫情的影响,多数建筑长期封闭导致供水系统长时间水流停滞,为军团菌的生长繁殖提供有利条件。2020年5至7月美国有报道称,包括美国疾控中心多处办公楼在内的供水系统、度假酒店的自来水以及大学校园的建筑供水均检出军团菌。感染军团菌可引起严重的呼吸道传染病,其中嗜肺军团菌(Legionella pneumophila,LP)与人类疾病关系最为密切。目前我国现行《生活饮用水卫生标准》(GB 5749-2006)未对军团菌指标提出控制要求,现有的微生物指标也无法准确提示军团菌污染水平。但美国环保署(US-EPA)2001年颁布的《国家饮用水水质标准》(EPA 816-F-09-004)中国家一级饮用水规程规定军团菌最大污染水平的控制目标为零。世界卫生组织(WHO)2011年发布的《饮用水水质准则》第四版也已将军团菌列入12种水源性病原体之一,明确其卫生学意义重大。
分离培养法是目前国际通用检测军团菌的“金标准”,适用于各种环境水体。但也有研究者提出该方法存在操作繁琐,检测周期较长,易受杂菌干扰等缺陷。近些年出现了多种新的嗜肺军团菌定量检测方法。其中,酶底物法作为一种同时适用于饮用水和非饮用水的嗜肺军团菌检测方法备受关注。北美、欧洲、日本等国家相继对该方法进行了能力验证及应用,普遍认为酶底物法具有操作简单、灵敏性高的特点,可用于检测饮用水中嗜肺军团菌。目前,我国还未对该方法在检测饮用水中嗜肺军团菌的可行性进行研究。基于此,本研究拟通过加标试验对酶底物法检测饮用水中嗜肺军团菌最适宜的培养条件进行探索,并运用该方法对饮用水水样进行检测分析,为进一步探索适用于饮用水中嗜肺军团菌的检测方法提供参考依据。
1 材料与方法
1.1 试验用菌种
试验所用的嗜肺军团菌质控样品NCTC 11192(ATCC 33152)购置于美国爱德士生物科技公司(IDEXX),单只质控样真值为1 604±335 MPN/100mL。
1.2 仪器和试剂
程控定量封口机(IDEXX),恒温培养箱,涡旋振荡器,生物安全柜,离心机,水浴锅,移液枪;酶底物培养基、定量盘(IDEXX),乳胶凝集试剂盒(OXOID),军团菌诊断血清试剂1-15型(天津生物芯片),BCYE和BCYECYE培养基(陆桥),QIAamp DNA Mini Kit试剂盒(QIAGEN)。
1.3 培养条件
1.3.1 方法原理
酶底物法是一种以细菌酶检测技术为基础,基于最可能数(most probable number, MPN)方法的定量检测方法。嗜肺军团菌利用酶底物试剂中丰富的氨基酸、维生素和其他营养成分迅速生长繁殖,同时会利用额外添加的酶底物反应生成一种棕色的指示物使溶液显褐色或者浑浊。
1.3.2 培养条件设置
本研究拟对培养温度和培养时间进行考察。根据分离培养法中军团菌最适培养温度为36±1℃以及酶底物法中建议的饮用水中嗜肺军团菌培养温度为39℃,本研究将培养温度设定为5组:33℃、36℃、39℃、42℃、45℃,每个温度条件设9个平行样,并在培养箱中放入一个装有足量水的托盘,以保持培养箱中湿度适宜。培养时间设定为11 d,样品在培养过程中每隔24h观察记录96孔定量盘的颜色和浊度变化,从第1 d到第11 d持续观察。
1.3.3 培养方法
嗜肺军团菌质控样品用适量无菌去离子水稀释,配制成高、中、低(321±67 MPN/100mL、64±13 MPN/100mL、8±2 MPN/100mL)三种不同浓度的100mL菌悬液作为阳性待测样品。在待测样品中加入酶底物培养基,振荡混匀并倒入96孔定量盘中,轻拍定量盘排出空气后放入程控定量封口机中封口,最后将定量盘纸片一面朝下,在33℃、36℃、39℃、42℃、45℃温度条件下培养。同时,用无菌水代替阳性待测样品,其他操作步骤同上述一致,设为阴性对照。
1.3.4 结果判读
相对阴性对照而言,无论浑浊与否,任何显褐色的迹象均认为嗜肺军团菌阳性;相对阴性对照而言,无论是否显褐色,浊度大于阴性对照即认为嗜肺军团菌阳性;如颜色与浊度方面与阴性对照无差异,认为嗜肺军团菌阴性。根据以上标准判读结果,数出显阳性的大小孔格数,对照MPN表得到嗜肺军团菌浓度(MPN/100mL)。
1.4 饮用水水样检测
1.4.1 水样的采集和检测
(1)采集水样:于2020年6月随机无菌采集北方某城市饮用水水样,每份样品100mL。水样低温运输回实验室后室温储存,3 d内进行酶底物法检测。
(2)培养方法:用水硬度测试条测定水样的硬度。根据水的硬度进行预处理:0~2个显色条呈阳性为低硬度,需向100mL水样中加入酶底物补充剂0.33mL,3~4个显色条呈阳性为高硬度,需向100mL水样中加入酶底物补充剂1mL。加入酶底物培养基到混合液中,振荡混匀,倒盘封口。按照条件探索试验确定的最适培养条件培养,同时设置阴性对照。结果判读同1.3.4。
1.4.2 阳性孔确证试验
本研究同时采用血清凝集和16S rDNA测序两种方法对阳性结果进行确证实验。
(1)血清凝集法:用接种环取10 μL阳性菌悬液涂布于BCYE和BCYE-CYE培养基上,在CO2培养箱37℃培养2~4 d。对在BCYE上生长、BCYE-CYE上无生长的菌落进行血清凝集型别鉴定,可分出血清1-15型。
(2)16S rDNA序列分析:DNA提取步骤按照QIAamp DNA Mini Kit试剂盒说明书进行;16S rDNA引物信息:引物F为5′-GTTAAGTCCCGCAACGA-3′;引物R为5′-CCAACAGCTAGTTGACATCG-3′,由某基因科技有限公司合成。PCR体系:1 μL模板,15 μL Super Mix,1 μL Primer F(10p),1 μL Primer R(10p),12 μL ddH2O,共30 μL。反应程序:96℃预变形5min;96℃变性20s,62℃退火20s,72℃延伸30s,35个循环;最后,72℃延伸10min。扩增后取3 μL PCR产物进行1.0%的琼脂糖凝胶检测并观察条带性状;PCR产物纯化按照磁珠纯化标准操作流程操作;纯化后的PCR产物由某基因科技有限公司进行16S rDNA测序分析。
1.5 质量控制
ATCC 33152为本次研究阳性对照质控菌株。
1.6 统计分析
数据采用SPSS19.0统计软件进行统计分析。嗜肺军团菌加标回收试验结果的比较采用单因素方差分析。
2 结果
2.1 培养条件
2.1.1 培养温度
加标试验结果显示,当培养温度为33℃时,嗜肺军团菌加标回收率在21.3%~75%;当培养温度为36℃时,嗜肺军团菌最大检出浓度接近加标浓度,加标回收率在89.5%~105%;当培养温度为39℃时,嗜肺军团菌最大检出浓度与加标浓度基本一致,加标回收率在98.4%~108.8%;当培养温度为42℃时,嗜肺军团菌最大检出浓度偏低,加标回收率在25.8%~51.4%;当培养温度为45℃时,嗜肺军团菌最大检出浓度明显偏低,加标回收率<34.6%。采用单因素方差分析进行统计学分析,结果显示F=17.90,p<0.05,认为5组数据有显著性差异,具体数据见表1。单因素方差分析两两比较结果显示,39℃组与36℃组数据没有统计学差异(p=0.576)。
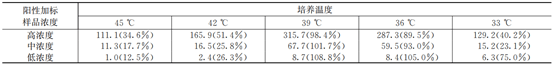
注:经单因素方差分析,p<0.05;
2.1.2 培养时间
由图1a可知,嗜肺军团菌阳性样品在高浓度时,当培养温度为45℃、42 ℃、39 ℃、36 ℃时,第4 d开始出现阳性现象,45℃、42 ℃、39 ℃ 时第7 d结果趋于稳定,36 ℃条件下第8 d结果趋于稳定;当培养温度为33℃时,第6 d开始观察到阳性现象,直到第11 d未观察到连续稳定结果即未达到最大检出浓度。由图1b可知,嗜肺军团菌阳性样品在中浓度,培养温度为42 ℃、39℃、36 ℃时,第4 d开始观察到阳性现象,并分别在第6 d、第7 d、第9 d结果趋于稳定;当培养温度为45℃、33℃时,第5 d开始观察到阳性现象,并分别在第6 d和第10 d结果趋于稳定。由图1c可知,嗜肺军团菌阳性样品在低浓度,培养温度为45℃ 时,未观察到阳性现象,分析可能是温度过高导致嗜肺军团菌死亡或者活性消失;当培养温度为42℃时,在第5 d出现阳性现象,第6 d结果趋于稳定;当培养温度为39℃、36℃时,第4 d开始观察到阳性现象,分别在第6 d和第9 d结果趋于稳定;当培养温度为33℃时,在第6 d观察到阳性现象,第10 d结果趋于稳定。
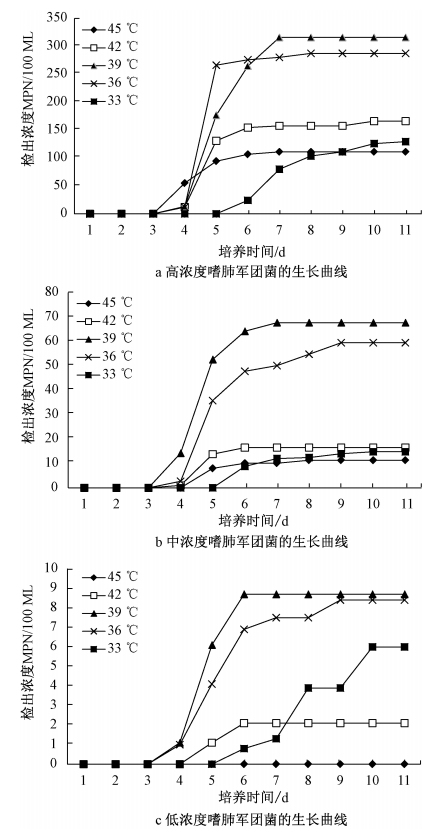
图1 不同浓度嗜肺军团菌随时间变化生长曲线
2.2 饮用水水样检测
本研究采用酶底物法对采集的饮用水水样进行了嗜肺军团菌检测,共检出嗜肺军团菌阳性样品4份,分离获得4株嗜肺军团菌,通过乳胶凝集血清学分型分别为1型、15型、7型、10型嗜肺军团菌;另外通过16S rDNA测序分析对其进行菌株确证,结果显示,分离的4株菌均属嗜肺军团菌,表现为2种基因型,命名为Lp-NO.1和Lp-NO.2。其中Lp-NO.1有2株,对应的血清型为1型和7型;Lp-NO.2有2株,对应的血清型为10型和15型。根据Blast结果显示,Lp-NO.1株与CP048618.1 Legionella pneumophila亲缘关系最近,相似性为100%;Lp-NO.2与LR134380.1 Legionella pneumophila subsp. pascullei亲缘关系最近,相似性为9977%。现基于16S rDNA测序结果建立的系统发育树如图2所示。

图2 基于16S rDNA测序结果的嗜肺军团菌系统发育树
3 讨论
3.1 培养温度和培养时间
培养温度是影响嗜肺军团菌生长繁殖的重要因素,一般认为军团菌可在20~50℃的水温环境下生存,最佳生存温度为25~42 ℃。研究表明,当酶底物法培养温度高至42℃以上或低至33℃以下时,嗜肺军团菌最大检出浓度均明显低于理论浓度的50%,即加标回收率均低于50%,说明高温可以杀灭嗜肺军团菌或使其活性丧失,而温度过低又会导致嗜肺军团菌活性降低,使显色反应延迟或不发生。本研究中,当培养温度为39℃和36℃时,嗜肺军团菌最大检出浓度值与理论浓度值基本一致,即均可达到较高的加标回收率,为较适宜的培养温度,且从图2的指数增长曲线可以看出39℃时嗜肺军团菌最大检出浓度比36℃时更接近理论浓度值,但未发现两者存在统计学差异。
培养时间对酶底物法具有显著的影响。相同温度条件下,随着培养时间的增加,嗜肺军团菌检出率增高。当温度≥39℃时指数增长阶段集中在第4~7 d,当温度<39℃时指数增长阶段集中在第4~10 d。结合培养温度的研究结果,重点比较39℃和36℃培养温度下嗜肺军团菌的生长趋势。结果显示,当培养温度为39℃时,高中低浓度阳性样品均能稳定在第4 d开始出现阳性显色现象,并在第6 d或第7 d达到最大检出浓度;当培养温度为36℃时,高中低浓度阳性样品均在第4 d开始出现阳性显色现象,并在第8 d或第9 d达到最大检出浓度。综合考虑培养温度与培养时间,在保证高回收率的同时尽可能缩短培养周期,本研究认为酶底物法在39℃条件下,选择7 d作为培养时间,嗜肺军团菌的检出效果最好。
3.2 方法的特异性
本研究通过酶底物法对北方某城市的部分饮用水水样进行检测,共检出嗜肺军团菌阳性4份,通过血清分型试验和16S rDNA序列分析对阳性样品进行确证,两种确证方法结果一致,4份阳性样品均为嗜肺军团菌。结果表明,本研究通过酶底物法检测获得的4份嗜肺军团菌阳性水样特异性为100%,这与Spies K等人的研究结果相同。
4 结论
嗜肺军团菌是饮用水中存在的潜在条件致病病原体。随着城市化发展进程加快,嗜肺军团菌在饮用水系统中滋生并传播的风险日益增大。因此加强对饮用水中嗜肺军团菌的检测和控制对保障用水安全至关重要。通过试验证明,酶底物法检测饮用水中嗜肺军团菌的最适宜培养条件为39℃恒温培养7 d。在适宜条件下,酶底物法检测饮用水中嗜肺军团菌具有良好的稳定性和特异性,并具有操作简单、结果易于判读等特点,在检测饮用水中嗜肺军团菌领域具有良好的发展和应用前景。
来源:给水排水公众号















